Новая стратегия использования антибиотиков в нейрореаниматологии: эффективность in vivo при «неэффективности» in vitro
Царенко С.В.1, Сидоренко С.В.2, Таирова К.Р.1, Петриков С.С.1, Березин А.Г.2
НИИ скорой помощи им. Н.В. Склифосовского1 (Москва, Россия),
ФГУП «Государственный Научный Центр Антибиотиков»2 (Москва, Россия).
Введение.
Значительные трудности в лечении нозокомиальной инфекции в настоящее время связаны с все более возрастающей резистентностью госпитальных микроорганизмов к используемым антибиотикам. В этиологии нозокомиальных инфекций не последнее место занимают грамположительные бактерии, но большинство проблемных возбудителей относятся к грамотрицательной флоре: к аэробным микроорганизмам из семейства энтеробактерий и группе неферментирующих бактерий (3,10). В последние годы принципиально новых препаратов для подавления грамотрицательных бактерий не найдено. Использование карбапенемов и цефалоспоринов последнего поколения зачастую экономически невозможно, а, кроме того, является временным решением из-за развития стойкой и длительной резистентности. В связи с этим целесообразным представляется рациональное использование имеющихся антибиотиков путем вариации их доз, длительности и времени введения. Данные литературы (9) позволили предположить, что эффективным и безопасным способом преодоления резистентности является использование повышенных дозировок антибиотиков с учетом их фармакокинетических особенностей, в частности постантибиотического эффекта. Настоящее исследование посвящено изучению данного подхода и возможному объяснению его эффективности.
Материалы и методы.
В период с января по июль 2003 года проведен мониторинг микрофлоры нижних дыхательных путей у 120 пациентов, проходивших лечение в 12-коечном специализированном отделении реанимации для нейрохирургических больных крупного медицинского центра экстренной помощи. Структура нозологии в обследованной группе больных была следующая: изолированная черепно-мозговая травма (52 пострадавших), разрыв церебральной артериальной аневризмы (36 пациентов), опухоль головного мозга (8 человек), острое нарушение мозгового кровообращение по геморрагическому типу (24 больных). В исследование включены только больные, тяжесть состояния которых на 2-3 день пребывания в реанимационном отделении составляла 4-8 баллов по Шкале Комы Глазго.
Все пациенты с момента поступления находились на искусственной вентиляции легких (ИВЛ) и перенесли от 2-х до 4-х эпизодов нозокомиальной пневмонии. Диагноз пневмонии был поставлен на основании трех и более из перечисленных клинических и лабораторно-инстументальных признаков:
• повышение температуры тела до фебрильных значений,
• отхождения обильного секрета при санации дыхательных путей,
• изменений в периферической крови (лейкоцитоз > 10х109/л или лейкопения < 10х104/л, появление незрелых форм лейкоцитов более 10),
• появление новых инфильтративных очагов на рентгенограмме легких в прямой проекции,
• снижение в динамике индекса рO2/FiO2 более 50 мм рт.ст.
Учитывая длительность пребывания на ИВЛ из-за характера поражения мозга, антибиотикотерапию проводили по принципам эскалации с учетом микробиологических результатов. Согласно схеме ротации, принятой в отделении, использовали аминогликозиды, цефалоспорины III-IV поколений и, в качестве резерва, карбапенемы. Остальные антибактериальные препараты из структуры терапии были временно исключены. Всем пациентам проводили инфузионную терапию кристаллоидными растворами в количестве 45-50 мл/кг. 2 раза в сутки осуществлялся контроль электролитов и биохимических показателей крови: мочевины, креатинина, билирубина.
Летальность в обследуемой группе составила 46% (55 больных). Из них смерть от отека и дислокации головного мозга отмечена у 84% (46 человек), смерть от пневмонии - у 16% (9 пациентов).
Структура летальности свидетельствовала о тяжести поражения мозга у обследованных больных.
Микробиологические методы.
Бронхиальный аспират, полученный методом бронхоальвеолярного лаважа, помещали в транспортую среду. Затем в микробиологической лаборатории получали чистую культуру возбудителя. Чувствительность выделенного возбудителя определяли двумя способами: диско-диффузионным методом и методом серийных разведений.
При стандартном способе (согласно рекомендациям NCCLS (Национального комитета по клиническим и лабораторным стандартам, США) постановки определения чувствительности диско-диффузионым методом (методом дисков) на соответствующую выделенному микроорганизму питательную среду (для грамотрицательных микроорганизмов – агар Мюллера-Хинтона, для грамположительных микроорганизмов – кровяной агар) в чашке Петри наносили бактериальную суспензию тестируемого микроорганизма c определенной плотностью (плотность суспензии оценивали визуально с помощью стандарта мутности по Мак-Фарланду). Затем на агар помещали диски, содержащие антибиотик в стандартной концентрации. Диффузия антибиотика в агар приводила к формированию зоны подавления роста микроорганизмов вокруг дисков. В зависимости от величины диаметра зоны подавления роста вокруг диска (максимального, в случае некруглой зоны задержки роста), измеренной в миллиметрах, микроорганизмы классифицировали как чувствительные (S - sensitive), умеренно-резистентные (I - intermediate) и резистентные (R – resistent) (рис 1.) [1,2].
Метод серийных разведений позволял количественно оценить чувствительность выделенного микроорганизма к антибиотику и определить минимальную концентрацию препарата в мкг/мл, подавляющую рост выделенного штамма возбудителя (МПК) (рис.2). При использовании данного метода в луночном планшете создавали серию последовательных разведений антибиотика. В первой лунке концентрация антибиотика была наиболее высокой. В каждой следующей лунке концентрация снижалась вдвое. Затем во все лунки добавляли исследуемый микроорганизм. В лунках с наибольшей концентрацией антибиотика отмечали отсутствие микробного роста (на рис. 2 - 1/8, 1/4, 1/2, а также лунка с исходной концентрацией антибиотика). В одной из лунок, где концентрации антибиотика становилась недостаточной, отмечался рост микроорганизма – появлялось помутнение бульона (на рис. 2 - 1/16). Очевидно, что микробный рост отмечался и в последующих лунках, с меньшей концентрацией препарата (на рис. 2 – 1/32, 1/64, 1/128, 1/256, 1/512). Концентрация антибиотика в последней лунке, в которой еще не было микробного роста, признавалась в качестве МПК для данного антибиотика и данного микроорганизма. Например, если концентрация антибиотика в первой лунке составляла 256 мкг/мл, то согласно рис. 2, МПК для изображенного микроорганизма составила 32 мкг/мл).
После этого полученные значения МПК сравнивали со стандартными величинами, так называемыми клиническими брейкпойнтами, установленными для каждого антибиотика и микроорганизма международными организациями химиотерапевтов на основе фармакокинетических, фармакодинамических, микробиологических и клинических данных (6). Если для подавления роста тестируемого микроорганизма в луночном планшете были необходимы концентрации антибиотика, меньшие или равные нижнему брейкпойнту МПК, то он считался чувствительным к данному антибактериальному препарату. Если определяемая методом серийных разведений подавляющая величина МПК находилась между нижним и верхним брейкпойнтом, то чувствительность была промежуточной. Если МПК превышала верхний брейкпойнт, то микроорганизм считался устойчивым.
У 34 из обследованных больных (27 мужчин, 8 женщин) была проанализирована эффективность и безопасность новых режимов антибактериальной терапии. Структура нозологии соответствовала всей обследованной группе. Указанным больным применяли антибиотики согласно следующему алгоритму:
•стартовый антибиотик - гентамицин 320 мг один раз в сутки внутривенно,
•при неэффективности - резервный антибиотик - амикацин 2,5 г один раз в сутки внутривенно,
•при неэффективности к амикацину добавляли или заменяли его фторхинолоном: офлоксацином (Таривид) 1 г 2 раз в сутки, левофлоксацином (Таваник) 500 мг 3 раза в сутки, ципрофлоксацином (Ципролет) 1 г 2 раза в сутки.
Дозы антибиотиков были выбраны с учетом данных литературы [5, 9], результатов предварительного анализа чувствительности микрофлоры отделения с расчетом МПК и одобрены больничным этическим комитетом. Антибиотикотерапию в виду тяжести состояния больных проводили эмпирически. При неэффективности лечения его заменяли, ориентируясь на микробиологические показатели.
Эффект антибиотика признавался положительным в случае, если отмечалось снижение температуры тела с фебрильных до субфебрильных и нормальных значений, снижение количества лейкоцитов в периферической крови, уменьшение и/или исчезновение инфильтративных очагов на рентгенограмме легких, повышение индекса рO2/FiO2. Летальность среди больных данной группы составила 50%. Из них смерть от отека и ишемии головного мозга наступила в 79% наблюдений (13 больных), смерть от гнойно-септических осложнений – в 21% случаев (4 пациента).
Результаты.
Этиологическая структура нозокомиальной пневмонии в отделении нейрореанимации представлена на рис. 3.
Из данных, представленных на рис.3, следует, что в отделении преобладали Грамотрицательные микроорганизмы. Они составили более 60% от общего числа бактерий. Лидирующие позиции занимала P. aeruginosa (20%). Среди Грамположительных бактерий наиболее часто встречался S. aureus (19%).
При исследовании чувствительности микроорганизмов к антибиотикам диско-диффузионным способом установлен высокий уровень резистентности бактерий к большинству антибактериальных препаратов (табл. 1).
Таблица 1. Доля резистентных микроорганизмов по отношению к общему числу проб, содержащих данный бактериальный штамм (в %).
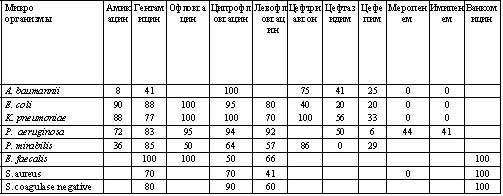 Таблица 1.
Таблица 1.
Примечание. Незаполненные поля в таблице означают отсутствие данных.
Анализ данных, представленных в таблице, свидетельствует о том, что только карбапенемы сохранили высокую эффективность. Однако даже к этим антибиотикам имелось значительное число устойчивых штаммов синегнойной палочки (более 40%).
Использование метода серийных разведений позволило установить не просто факт устойчивости микроорганизмов к антибиотикам, но и уточнить степень резистентности. На рисунках 4-10 представлены величины МПК основных исследованных антибиотиков. На оси ординат отражена доля (в %) микроорганизмов от общего числа обследованных штаммов, по оси абсцисс – величина МПК в мкг/мл. Вертикальными линиями обозначены верхний и нижний брейкпойнты чувствительности к антибиотику. Анализ был проведен как для всех потенциально чувствительных бактерий в целом, так и для отдельных видов микроорганизмов. Ограниченный размер публикации не позволяет продемонстрировать все полученные данные, поэтому мы приводим только результаты чувствительности к отдельным антибиотикам для всех бактерий и, в ряде случаев, отдельно для Pseudomonas aeruginosa.
Анализ результатов, приведенных на рисунках 4-5, показывает, что к аминогликозидам в отделении сформирована высокая устойчивость. Особенно неблагоприятная ситуация сложилась с гентамицином: для подавления роста большинства штаммов необходимы очень высокие концентрации антибиотика. Синегнойная палочка продемонстрировала наибольшую резистентность среди исследованных микроорганизмов как к гентамицину, так и к традиционному «антисинегнойному» аминогликозиду – амикацину.
Анализ чувствительности бактерий к фторхинолонам (рис.6) продемонстрировал, что наибольший уровень резистентности отмечался к ципрофлоксацину. Несколько лучше ситуация была с чувствительностью к офлоксацину и левофлоксацину. Обращал внимание тот факт, что формально к стандартным дозам левофлоксацина было примерно столько же устойчивых штаммов, что и к офлоксацину. Однако в отличие от офлоксацина большинство резистентных к стандартным дозам левофлоксацина штаммов не требовало для подавления роста очень высоких концентраций антибиотика.
Сравнение эффективности цефалоспоринов (рис.7) показало, что самый высокий уровень резистентности отмечался для цефтриаксона. Самая благоприятная ситуация была с цефепимом. Большинство устойчивых к стандартным дозам цефепима микроорганизмов требовало лишь незначительного повышения концентрации антибиотика для подавления их роста.
Анализ чувствительности микроорганизмов к карбапенемам (рис.8, 9) продемонстрировал самую благоприятную ситуацию. Только Pseudomonas aeruginosa имела высокий уровень резистентности к стандартным дозам как имипенема, так и к меропенема.
В качестве примера распределения чувствительности Грамположительных бактерий к антибиотикам приведем результаты исследований с ванкомицином (рис.10). 100% микроорганизмов продемонстрировали высокую чувствительность к этому антибиотику.
Предварительный анализ полученных результатов позволил предположить, что для эмпирической терапии повышенными дозировками аминогликозидов и фторхинолонов имеются серьезные основания. Учитывая тот факт, что Pseudomonas aeruginosa не являлась, как правило, первичной микрофлорой, высевавшейся из нижних дыхательных путей, мы не стали исключать гентамицин из схемы антибиотикотерапии. В виду того, что результаты микробиологического исследования были получены после начала антибиотикотерапии, мы сравнили клиническую эффективность антибиотиков с результатами, полученными in vitro диско-диффузионным методом, ретроспективно (табл.2).
Таблица 2. Чувствительность выделенных микрорганизмов к аминогликозидам и фторхинолонам in vitro (по данным диско-диффузионного метода) и клиническая эффективность in vivo.
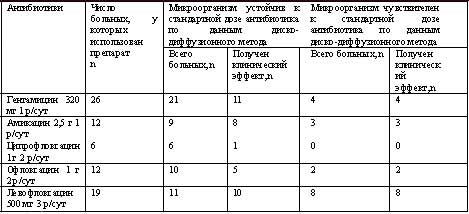 Таблица 2.
Таблица 2.
Примечание: Общее число больных в таблице (n) превышало 34 человека, так как каждый пациент получал несколько антибиотиков.
Анализ таблицы показал высокую эффективность использованных доз амикацина и левофлоксацина. Меньшая эффективность отмечена у офлоксацина и гентамицина. Ципрофлоксацин, несмотря на повышенные дозировки, оказался неэффективным.
У анализируемой группы больных клинических побочных эффектов при применении повышенных доз антибиотиков зарегистрировано не было. Значения лабораторных показателей - билирубина, креатинина, мочевины были в пределах нормальных значений (табл.3).
Таблица 3. Биохимические показатели крови в процессе лечения повышенными дозировками аминогликозидов и фторхинолонов у 34 больных.
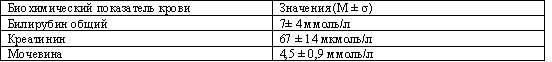 Таблица 3.
Таблица 3.
Дискуссия.
Своеобразие нейрореанимационных больных определяется длительными сроками пребывания в реанимационном отделении, широком использовании инвазивных средств мониторинга, проведением многодневной ИВЛ. Сочетание этих факторов приводит к развитию гнойно-септических осложнений, в первую очередь пневмоний, являющихся основной причиной смерти пациентов, благополучно переживших острый период заболевания или травмы.
Лечение пневмоний у этих больных имеет серьезное внутреннее противоречие. С одной стороны, известно, что при наличии пневмонии эффективная антибактериальная терапия требует максимально раннего назначения антибиотиков, к которым чувствительна внутрибольничная микрофлора (4, 7). С другой стороны, наиболее часто пневмонии осложняют церебральную патологию только с 5-7 суток от момента заболевания или травмы. Кроме того, при сохраняющихся нарушениях сознания даже успешно вылеченная пневмония может повторно осложнять течение церебральной патологии. В силу этого, основой тактики в нейрореанимации не может быть деэскалация, т.е. безотлагательное применение эффективных резервных антибиотиков (например, карбапенемов). Тактика деэскалации значительно ограничивает последующие возможности лечения рецидива пневмонии. В связи с этим в большинстве клинических ситуаций в нейрореаниматологии используют тактику эскалации - постепенное наращивание эффективности антибиотикотерапии. В то же время назначаемые в рамках эскалации антибиотики должны быть эффективными. Для эффективного подбора препаратов времени для исследования микрофлоры конкретного больного, как правило, нет. В связи с этим антибиотики должны назначаться эмпирически. Выбрать эмпирически назначаемые эффективные препараты позволяет мониторинг микрофлоры конкретного отделения реанимации.
Вторая проблема - нарастающая резистентность микробной флоры из-за необходимости повторных курсов антибактериальной терапии. До недавнего времени эту проблему решали путем использования вновь появляющихся препаратов. В настоящее время этот экстенсивный путь зашел в тупик из-за того, что микроорганизмы быстрее формируют устойчивость, чем успевают появляться на рынке новые антибиотики. Решение проблемы - в альтернативном пути: более рациональном использовании имеющихся препаратов. Существует два способа интенсификации:
• повышение дозы препаратов с учетом минимально подавляющих концентраций (МПК) путем использования фармакокинетических свойств антибиотиков
• ротация антибиотиков
С точки зрения фармакокинетики можно выделить два типа антибиотиков: с постантибиотическим эффектом и время-зависимым действием. Эффективность препаратов первого типа зависит от пиковой концентрации в крови и ее отношения к минимально подавляющей концентрации. К этой группе относятся аминогликозиды и фторхинолоны (частично – карбапенемы). К препаратам с время-зависимым действием относятся β-лактамы (пенициллины, цефалоспорины и, в основном, карбапенемы). Эффективность препаратов этого типа зависит от времени поддержания их концентрации в крови на уровне выше минимально подавляющей концентрации. Исходя из таких особенностей, препараты первого типа лучше применять большими редкими дозами, а антибиотики второго типа – более низкими, но частыми дозами (возможно, в режиме эпизодической инфузии).
В данной работе анализируется эффективность первого способа повышения эффективности антибиотикотерапии – повышение дозировок. Проведенное исследование показало, что для подбора оптимальных доз препаратов недостаточно ориентироваться на данные стандартного диско-диффузионного анализа с использованием коммерческих дисков. Стандартный микробиологический анализ учитывает только обычные дозы и обычные режимы введения антибиотиков, поэтому формирует ложное впечатление о неэффективности большинства антибактериальных препаратов. Однако оценка индивидуальной МПК для конкретных микроорганизмов отделения реанимации показала, что теоретически резистентность микроорганизмов можно преодолеть за счет изменения режима введения препарата и повышения его дозировки.
Анализ наших результатов показал, что за исследованный период в отделении нейрохирургической реанимации преобладала полирезистентная Грамотрицательная флора. Результаты диско-диффузионного метода и метода серийных разведений в целом совпадали. Обращало внимание, что резистентность отмечалась практически ко всем антибактериальным препаратам, включая карбапенемы. Дополнительный анализ показал, что безусловным «лидером» резистентности была Pseudomonas aurogenosa. В то же время другие Грамотрицательные микроорганизмы сохраняли чувствительность к аминогликозидам и карбапенемам. Из-за ограничений размера публикации мы не привели данных по чувствительности отдельных микроорганизмов к другим антибиотикам, однако там отмечалась аналогичная картина.
Сравнение данных МПК гентамицина и амикацина подтвердило известный факт преимущества последнего препарата, особенно в отношении синегнойной инфекции. Обращало внимание то обстоятельство, что для подавления резистентных штаммов нужны были меньшие концентрации амикацина, чем гентамицина.
Вызвал удивление факт отсутствия преимуществ меропенема перед имипенемом по отношению к синегнойной палочке, несмотря на наличие у первого препарата двух механизмов подавления этого микроорганизма против только одного, присущего имипенему.
Сравнение трех фторхинолонов показало меньшую устойчивость микроорганизмов к левофлоксацину и офлоксацину по сравнению с ципрофлоксацином. Данный факт тоже является необычным, так как традиционно ципрофлоксацин считается более предпочтительным препаратом, особенно при синегнойной инфекции (11). Не вызвал удивления факт преимущества левофлоксацина перед офлоксацином, хотя они и представляют собой одно и тоже вещество. Офлоксацин, как известно, является рацемической смесью активного L-изомера и неактивного D-изомера, тогда как левофлоксацин – чистый L-изомер. Фактически тот же антибактериальный эффект должен достигаться одинарной дозой левофлоксацина и двойной дозировкой офлоксацина. Однако более детальный анализ результатов серийных разведений продемонстрировал большее число бактерий с бόльшими МПК к офлоксацину, чем к левофлоксацину, что не столь легко объясняется арифметическими расчетами дозировок.
Сравнение МПК цефалоспоринов показало меньший уровень резистентности к цефепиму по сравнению с цефтриаксоном и цефтазидимом, что подтверждает известные преимущества цефалоспоринов IV поколения. Анализ чувствительности Грамположительных микроорганизмов к ванкомицину выявил благоприятную картину чувствительности к антибиотику. Мы объясняем данный факт сравнительно редким использованием данного антибиотика в отделении.
На основании значений индивидуальной минимально подавляющей концентрации при сравнении со стандартными значениями МПК, мы предположили, что можно попытаться преодолеть резистентность за счет повышения дозы ряда применяемых антибактериальных средств.
Согласно исследованиям in vitro диско-диффузионным методом, гентамицин в стандартных дозировках у 100% обследованных пациентов считался неэффективным препаратом. Однако при применении повышенной дозы гентамицин оказался клинически эффективен у 42% исследуемых пациентов. Устойчивость к действию препарата обнаружена только у больных, основным патогенным микроорганизмов у которых была Pseudomonas aeruginosa.
Амикацин в повышенной дозе был клинически эффективен у более 89% пациентов, причем более чем у половины из них именно против Pseudomonas aeruginosa. По данным диско-диффузионного метода у всех больных с синегнойной инфекцией амикацин должен был бы быть неэффективен в стандартных дозировках.
Применение офлоксацина и левофлоксацина в повышенных дозах дало клинический положительный результат у большинства пациентов, (соответственно у 83% и 91%), тогда как согласно микробиологическим результатам от стандартных доз препаратов такого эффекта следовало ожидать только у16% и 42% больных соответственно.
Применение ципрофлоксацина было практически неэффективным, несмотря на высокие дозировки. Вероятным объяснением служит высокая МПК препарата. Повысить терапевтическую дозу ципрофлоксацина в 32 раза для создания достаточной МПК оказалось практически невозможно.
Изучение побочных эффектов препаратов не выявило серьезных проблем. Следует, однако, отметить, что мы не могли оценить возможные ототоксические эффекты аминогликозидов из-за того, что все больные были в бессознательном состоянии.
Можно предположить, что использованный нами фармакокинетический подход будет эффективен и при применении других групп антибиотиков. Сравнительно недавно показано, что при инфузионном применении карбапенемов повышается МПК этих препаратов и увеличивается эффективность (8). Не исключено, что аналогичные результаты можно получить при использовании цефалоспоринов.
Выводы:
1. Метод серийных разведений имеет преимущество перед диско-диффузионным анализом, так как позволяет получить информацию не только о факте резистентности микроорганизма к антибиотику, но и оценить величину этой устойчивости.
2. Сравнение стандартной минимально подавляющей концентрации антибиотика к возбудителю, создаваемой при введении обычных терапевтических доз с реально необходимой МПК антибиотика позволяет предложить эффективные способы преодоления резистентности микроорганизмов путем подбора безопасных повышенных дозировок.
3. Применение ряда фторхинолонов и аминогликозидов в повышенных дозировках - это один из возможных безопасных способов повышения эффективности антибиотикотерапии при лечении нозокомиальной инфекции в отделении реанимации в условиях полирезистентной флоры.
4. Высокий уровень резистентности к ципрофлоксацину не позволяет рассматривать его в качестве препарата для лечения грамотрицательных нозокомиальных инфекций даже в повышенных дозах.
Литература:
1. Решедько Г.К., Cтецюк О.У. Особенности определения чувствительности микроорганизмов диско-диффузионным методом. // В кн. Методические рекомендации. Методы бактериологического исследования условно-патогенных микроорганизмов в клинической микробиологии. М.; 1991; c. 18.
2. Сидоренко С.В., Колупаев В.Е. Антибиотикограмма: диско-диффузионный метод. Интерпретация результатов. М., Sanofi Pasteur, 1999; 32 с.
3. Anonymous. Guidelines for the management of adults with hospital acquired, ventilator-associated, and healthcare-associated pneumonia //Am J Respir Crit Care Med. – 2005 – Vol. 171. – P. 388–416.
4. Chastre J, Fagon JY. Ventilator associated pneumonia //Am J Respir Crit Care Med. – 2002.- Vol. 165.- P. 867–903.
5. Hollander J., Fuursted K., Verbrugh H., Mouton J. Duration and Clinical Relevance of Postantibiotic Effect in Relation to the Dosing Interval // Antimicrobial Agents and Chemotherapy.- 1998, Vol. 42. – P. 749-754.
6. Kahlmeter G, Brown D, Goldstein F, MacGowan A, Mouton J, Osterlun A, Rodloff A, Steinbakk M, Urbaskova P and Vatopoulos A. European harmonization of MIC breakpoints for antimicrobial susceptibility testing of bacteria // Journal of Antimicrobial Chemotherapy. - 2003. – Vol. 52. – P. 145–148
7. Kollef MH, Ward S, Sherman G, Prentice D, Schaiff R, Huey W, Fraser VJ. Inadequate treatment of nosocomial infections is associated with certain empiric antibiotic choices // Crit Care Med. – 2000 - Vol. 28.- P. 3456–3464
8. Mattoes HM, Kuti JL, Drusano GL, Nicolau DP. Optimizing antimicrobial pharmacodynamics: Dosage strategies for meropenem//Clinical Therapeutics. – 2004. – Vol. 26. – P. 1187-1198.
9. Miyagawa C.I. Aminoglycosides in the intensive care unit: an old drug in a dynamic environment // New Horizons – 1993. – Vol. 2. – P. 172-180.
10. Rello J, Ollendorf DA, Oster G, Vera-Llonch M, Bellm L, Redman R, Kollef MH. Epidemiology and outcomes of ventilator-associated pneumonia in a large US database // Chest. – 2002. – Vol. 122. – P. 2115–2121
11. Wise R, Honeybourne D. Pharmacokinetics and pharmacodynamics of fluoroquinolones in the respiratory tract //Eur Respir J. – 1999. – Vol. 14. – P. 221-229.






